Ist die Erde im heimischen Garten zu trocken, kann der Dürre mit einem Rasensprenger rasch Abhilfe geschafft und die nötige Bewässerung sichergestellt werden. Problematisch wird es jedoch dann, wenn sich das Gerät – etwa durch einen Defekt – nicht mehr ausschalten lässt und damit beginnt, den Garten zu überfluten.
Ein ähnliches Szenario kann sich auch im menschlichen Körper abspielen. Unsere Immunzellen enthalten Gefahrensensoren, mithilfe derer sie bei einer Bedrohung Signale aussenden, um den Körper eine kontrollierte Entzündung auslösen zu lassen. Hört aber der Gefahrensensor – ähnlich wie der defekte Rasensprenger – nicht auf, diese Signale zu senden, kommt es zu einer chronischen Entzündung, die für uns gefährlicher werden kann als der Krankheitserreger, den sie eigentlich bekämpfen sollte.
Forscher von Novartis wollen diesen Teufelskreis durchbrechen, indem sie insbesondere bei chronischen Krankheiten einen Teil der körpereigenen Gefahrensensoren zum Schweigen bringen. Dieses System, das von einer molekularen Maschine, dem sogenannten Inflammasom, angetrieben wird, steht im Aufmerksamkeitsfokus der Wissenschaftler: Eine Milderung dieser Funktion könnte möglicherweise dazu beitragen, gefährliche Dauer-Entzündungen dort zu stoppen, wo sie beginnen. Dieser präzise Ansatz zur Senkung des Entzündungsniveaus im Körper ist Teil eines umfassenderen Bestrebens, neue Wege zur Behandlung chronischer Krankheiten zu finden, und zwar von der Alzheimer-Krankheit über Krebs bis hin zu Osteoarthritis und Gicht.
Angesichts dieser überraschend simpel wirkenden Idee, das Inflammasom einfach ins Visier zu nehmen, erscheint es recht seltsam, warum bisher noch nicht damit begonnen wurde – doch noch vor zwei Jahrzehnten wusste noch niemand, dass ein solcher Gefahrensensor überhaupt existiert.
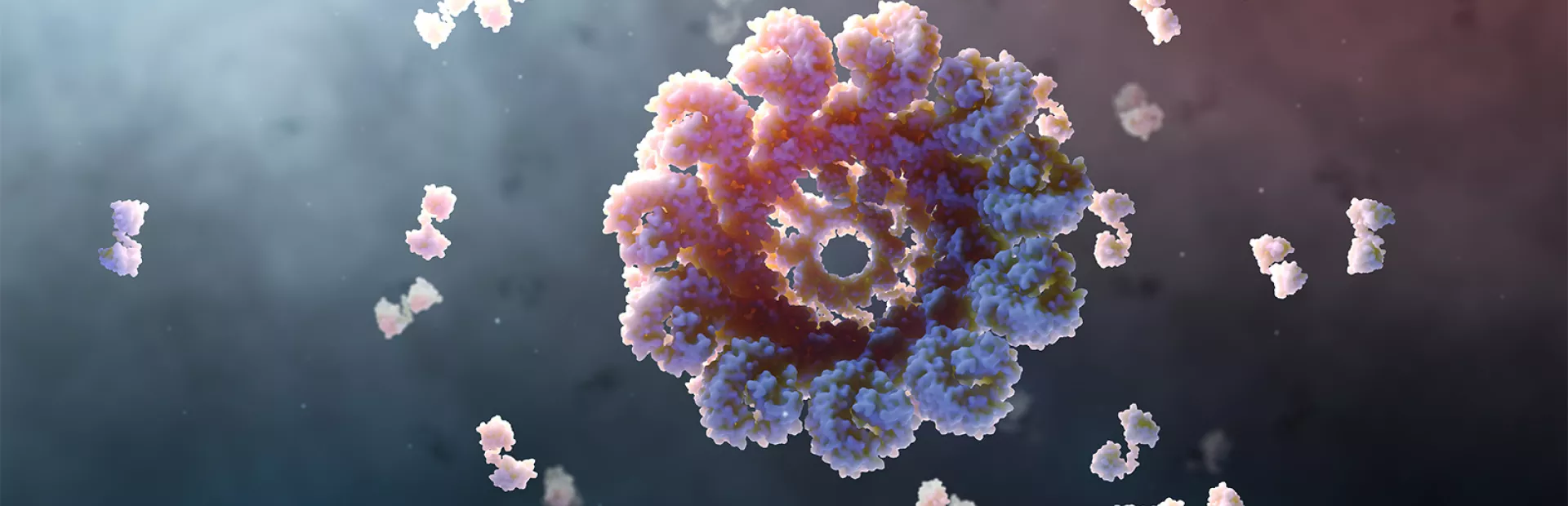
Was ist das Inflammasom? Animation von Mark Mazaitis.
"Aus evolutionärer Sicht ist das einer der ältesten Mechanismen der Biologie, und wir haben erst vor Kurzem davon erfahren", sagt Guido Junge, Experte für Entzündungskrankheiten an den Novartis Institutes for BioMedical Research (NIBR). "Wir vermuten, dass er bei vielen Krankheiten eine tragende Rolle spielt."
Ein mächtiges System
Im Jahr 2001 entdeckten Wissenschaftler in den USA eine Mutation in einem Gen, das bei der Herstellung eines Proteins namens NLRP3 fungiert. Damals wussten sie nur eines über NLRP3: Mutationen, die dieses Protein verändern, sind verheerend für die Menschen, bei denen sie auftreten.
"Es war ein wahrgewordener Traum, dieses Gen endlich zu finden", sagt Dan Kastner, Experte für Entzündungskrankheiten und wissenschaftlicher Direktor am US National Human Genome Research Institute. Er deckte Ende der 1990er Jahre die genetischen Ursprünge einiger verwandter Krankheiten auf. "Obwohl es Spekulationen gab, dass dieses Gen Entzündungen irgendwie regulieren könnte, wusste niemand, was es eigentlich bewirkt. An die Idee einer Behandlung war damals also bei Weitem noch nicht zu denken."
Unbehandelt haben Kinder mit NLRP3-Mutationen nahezu konstantes Fieber, Schüttelfrost und Gelenkschmerzen. Chronische Entzündungen fordern ihren Tribut, ihr Leben verläuft häufig sehr kurz.
Nicht lange nach der Entdeckung von NLRP3 stellten Forscher einen Zusammenhang zwischen NLRP3 und dem Inflammasom her, und weitere Forschungen brachten es mit einem Entzündungssignal namens IL-1 beta in Verbindung. Diese Entdeckung versprach Hoffnung auf weitere Erkenntnisse, denn: Erhöhte IL-1 beta-Spiegel sind ein Zeichen für eine chronische Entzündung, die als Orientierungshilfe dienen kann.
"Man schaut sich tonnenweise Daten an und sieht plötzlich ein Muster", sagt Junge. "Ein Signal, das helfen könnte, Therapien zu steuern."

Heute ermöglichen Medikamente, die das Entzündungssignal IL-1 beta blockieren, Patienten mit NLRP3-Mutationen ein längeres und vitaleres Leben.
"Das Inflammasom ist ein sehr leistungsfähiges System, das sich sehr vorteilhaft modulieren lässt", sagt Kastner. "Diese ersten Forschungserfolge geben uns Hoffnung auf einen Nutzen in subtileren, schwierigeren Situationen, wie z.B. bei chronischen Krankheiten", so Kastner.
Chronische Krankheiten und ein Gefahrensensor ausser Kontrolle
Die Forscher fanden schliesslich heraus, dass NLRP3 ein Gefahrensensor ist, von denen der menschliche Körper über 24 verfügt. Die meisten von ihnen reagieren auf Bakterien und Viren. Doch der NLRP3-Sensor ist anders: Er erkennt Kristalle, Proteinaggregate und ungesunden zellulären Stress.
Sobald er diese Gefahren wahrnimmt, baut er sich selbst zu einem Inflammasom zusammen, das einer mikroskopischen Strahlenkanone ähnelt. Ihre Aufgabe ist es, das übrige Immunsystem zu alarmieren, damit es eine Entzündungsreaktion auslöst um das Problem zu lösen.
Erinnern wir uns an den defekten Rasensprenger: Die Situation wird kritisch, wenn der NLRP3-Sensor kontinuierlich Alarmsignale aussendet. Dies kann einerseits durch Mutationen im Gen verursacht werden, aber die Forscher fanden auch heraus, dass chronische Krankheiten ebenso dazu führen können, dass der NLRP3-Sensor ständig Gefahr wittert.
Bei der Alzheimer-Krankheit zum Beispiel können Ablagerungen im Gehirn den Sensor auslösen. Ebenso können verhärtete Arterien bei Patienten mit Herz-Kreislauf-Erkrankungen und Kristalle, die bei Patienten mit Gicht auftreten, einen konstanten Entzündungszustand durch ein Dauerfeuer an Alarmsignalen erzeugen.
Es handelt sich um einen der wohl ältesten Mechanismen in der Biologie. Wir vermuten, dass er bei vielen Krankheiten eine tragende Rolle spielt.
Guido Junge
«Es handelt sich um einen der wohl ältesten Mechanismen in der Biologie. Wir vermuten, dass er bei vielen Krankheiten eine tragende Rolle spielt.» - Guido Junge
"Wenn unser Immunsystem chronisch alarmiert ist, ist das gar nicht gut", sagt Jörg Eder, ein Immunologie-Experte bei Novartis. "Die meisten Leute denken, das Problem sei die Krankheit selbst, aber die Gewebeschäden können auch direkt vom Immunsystem herrühren".
Bei Krebs zum Beispiel fungieren die Tumorzellen boshafterweise selbst als Gefahrensignale und lösen das Inflammasom aus. Die daraus resultierende Entzündung fördert schliesslich das Tumorwachstum, anstatt einen Angriff auf das kanzerogene Gewebe auszulösen. Infolgedessen bleiben die Krebszellen bestehen und agieren weiterhin als Gefahrensignale.
"Chronische Krankheiten können einen Teufelskreis aus Entzündungen, Schädigungen und noch mehr Entzündungen verursachen", sagt Junge.
Das NLRP3-Inflammasom kann auch in einigen Fällen von COVID-19 beteiligt sein. Bei einigen Patienten mit COVID-19 kommt es zu einer unkontrollierten Immunreaktion auf das Coronavirus. Ärzte bezeichnen diesen Vorgang als "Zytokinsturm", weil das Immunsystem die Lungen mit Entzündungssignalen wie IL-1 beta praktisch überflutet. Dies ist ein Beispiel dafür, dass eine Flut von Immunsignalen als Reaktion auf die virale Schädigung zu einem brausenden Sturm werden kann, der schwere bleibende Schäden verursachen kann. Wissenschaftler auf der ganzen Welt testen bestehende Medikamente, die das Immunsystem beruhigen, um festzustellen, ob sie gegen COVID-19 sicher und wirksam sein könnten.
Den Gefahrensensor drosseln
Mehrere Unternehmen, darunter Novartis, haben eine Reihe von Möglichkeiten zur Unterbrechung des NLRP3-Inflammasoms identifiziert. Es gibt viele praktikable Ansätze, von der Blockierung der Signale, die das Inflammasom produziert, bis hin zur Verhinderung, dass sich das Inflammasom überhaupt erst mobilisiert.
Forscher von Novartis haben einen Weg gefunden, die NLRP3-Aktivierung zu blockieren. Gleichzeitig machten Forscher eines Unternehmens namens IFM Tre eine ähnliche Entdeckung. Beide Ansätze erwiesen sich als komplementär und erreichten auf unterschiedliche Weise dasselbe Ziel der Entzündungshemmung.
Novartis akquirierte IFM Tre im Jahr 2019 und ist somit das erste Unternehmen, das eine Anti-NLRP3-Therapie in frühen klinischen Studien am Menschen erprobt hat. Viele werden noch folgen. denn: Es gibt noch viel darüber zu lernen, wie Patienten mit chronischen Krankheiten auf diesen therapeutischen Ansatz ansprechen.
"Das ist unsere grosse Aufgabe, die vor uns liegt", sagt Eder. "Wir müssen die chronischen Entzündungsherde finden, die die fatale NLRP3 Kettenreaktion auslösen, und damit beginnen, unsere Hypothese an Patienten zu testen", sagt Eder.