Par Elizabeth Dougherty
Chez tous les êtres vivants, les cellules disposent d’une fonction de recherche et de suppression intégrée. L’existence d’un tel mécanisme était encore inconnue jusqu’à il y a une trentaine d’années, jusqu’au jour où des chercheurs faisant des expériences sur des pétunias l’ont découvert par accident. Mais aujourd’hui, les chercheurs veulent utiliser cette propriété en médecine.
Les médicaments exploitant ce mécanisme de recherche et de suppression ont pour but d’inhiber la production de protéines liées à une maladie en ciblant l’ARN, c’est-à-dire les instructions utilisées en temps normal par les cellules pour former les protéines. Ce nouveau type de médicaments a le potentiel d’interrompre quasiment n’importe quel processus pathologique dans l’organisme. Novartis développe par exemple des traitements expérimentaux et innovants ciblant l’ARN et susceptibles de baisser le taux de cholestérol et de réduire le risque d’événements traumatiques en lien avec une cardiopathie, comme l’infarctus du myocarde, ou avec un accident vasculaire cérébral (AVC).
Dans cet article, nous vous proposons une visite en images de l’histoire des médicaments ciblant l’ARN, de 1990 à aujourd’hui.
Le problème des pétunias violets

En 1990, un chercheur de l’Université de l’Arizona a voulu rendre la couleur de pétunias violets encore plus intense. Son équipe a introduit dans la plante des gènes codant pour la couleur violette puis elle a attendu la floraison. Mais l’expérience a mal tourné: au lieu d’être d’un violet profond, les pétunias étaient d’une éclatante blancheur.
Les instructions relatives aux pigments violets que les chercheurs avaient introduites dans la plante avaient par inadvertance – et mystérieusement – inhibé les instructions violettes naturelles de la fleur sans modifier l’ADN de celle-ci. Aujourd’hui, ce mécanisme est appelé interférence par ARN; c’est l’une des deux manières possibles de perturber la production de protéines en ciblant leur ARN. Cependant, ces possibilités étaient encore inconnues en 1990. Une expérience ratée et un bouquet de pétunias blancs, voilà tout ce dont disposaient les chercheurs.
Du mystère à un outil efficace

L’expérience sur les pétunias a incité des chercheurs du monde entier à en savoir plus. Une équipe, dirigée par les chercheurs Craig Mello et Andrew Fire, a expérimenté le ciblage de l’ARN chez de minuscules vers appelés C. elegans.
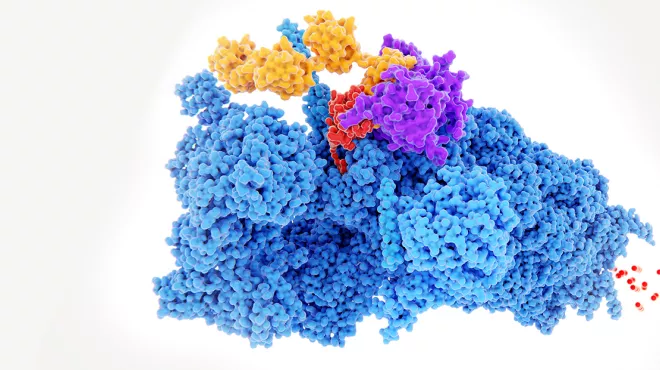
C. Mello et A. Fire ont fabriqué un ARN double brin composé d’acides nucléiques, les «briques» de l’ADN et de l’ARN. Le motif du brin d’acides nucléiques correspondait aux instructions de l’ARN pour une myoprotéine produite par les vers. Lorsqu’ils ont injecté le brin dans les vers, celui-ci a supprimé les instructions de l’ARN correspondantes dans les cellules des C. elegans.
C’était comme s’ils avaient entré le code de l’ARN cible dans le champ «Rechercher et supprimer» d’un logiciel de traitement de texte et qu’ils avaient appuyé sur la touche «Entrée». Les vers ont arrêté de produire la myoprotéine et ont commencé à convulser, un effet secondaire connu de cette carence protéique.
En imitant ce mécanisme, les chercheurs pourraient potentiellement perturber la production de quasiment toutes les protéines, y compris celles impliquées dans des maladies. En raison du potentiel de cette découverte à changer durablement la médecine, C. Mello et A. Fire ont reçu le prix Nobel 2006 de physiologie ou médecine.
Aujourd’hui, plusieurs médicaments autorisés sont à base d’ARN. Ces médicaments agissent de différentes manières: certains d’entre eux utilisent un «petit ARN interférent» et d’autres encore des brins uniques d’ARN appelés «oligonucléotides antisens» pour rechercher et supprimer une protéine liée à une maladie. En outre, certains vaccins contre le COVID-19 utilisent l’ARN messager (ARNm) pour entraîner le système immunitaire à reconnaître les protéines virales et à s’en prémunir.
Le parfait camouflage

La possibilité de rechercher et de supprimer les instructions de l’ARN est depuis lors utilisée en laboratoire à des fins de recherche, mais il a fallu attendre près de 20 ans après les découvertes de C. Mello et A. Fire pour que les promesses du ciblage de l’ARN soient également exploitées dans le développement de médicaments.
Un des défis résidait dans le fait que les acides nucléiques qui composent les médicaments ciblant l’ARN sont très similaires aux envahisseurs viraux. Lorsque ces brins circulent dans l’organisme, le système immunitaire humain répond par une réaction défensive.
Pour qu’un médicament ciblant l’ARN soit efficace, il doit circuler dans l’organisme et atteindre sa destination cellulaire sans se faire remarquer. Les chercheurs ont donc imaginé d’astucieux camouflages fonctionnant comme une cape d’invisibilité: un atome supplémentaire ici et une infime modification chimique là peuvent empêcher le médicament ciblant l’ARN d’être détecté par le système immunitaire.
Des médicaments d’un nouveau genre

Parfois, les médicaments ciblant l’ARN contiennent le brin de recherche camouflé mais aussi une petite molécule guidant le brin vers une cellule cible à la manière d’un système de navigation. Le guide assure que les instructions de l’ARN ciblé ne sont supprimées que dans les bonnes cellules, par exemple dans une cellule cancéreuse ou dans une cellule qui produit une protéine pathogène.
Dès que le médicament a trouvé la bonne cellule, il pénètre à l’intérieur et s’y installe, ce qui est comparable à une application fonctionnant en arrière-plan sur nos smartphones. Le médicament ciblant l’ARN, camouflé et guidé avec précision, peut faire son travail des mois durant sans interruption, en supprimant de manière répétée les instructions de l’ARN.
En règle générale, les médicaments ciblant l’ARN sont formulés sous forme d’injections. Certains d’entre eux pouvant rester actifs pendant des mois, ces injections peuvent être éventuellement administrées moins fréquemment. Cela en fait des médicaments d’un nouveau genre, tant du point de vue de la pratique clinique que du point de vue biologique.