Si la terre d’un jardin est trop sèche, il est possible d’y remédier rapidement à l’aide d’un arroseur et d’assurer l’irrigation nécessaire. Cependant, si l’appareil ne peut plus être arrêté, par exemple en raison d’un défaut, et commence à inonder le jardin, la situation devient problématique.
Un scénario similaire peut également se produire dans le corps humain. Nos immunocytes contiennent des capteurs de danger grâce auxquels ils envoient, en cas de menace, des signaux pour permettre à l’organisme de déclencher une inflammation contrôlée. Toutefois, si le capteur de danger, semblable à un arroseur défectueux, ne cesse d’envoyer ces signaux, il se produit une inflammation chronique susceptible de devenir plus dangereuse pour nous que l’agent pathogène qu’elle est censée combattre.
Les chercheurs de Novartis veulent briser ce cercle vicieux en réduisant au silence une partie des capteurs de danger de l’organisme, en particulier dans le cas des maladies chroniques. Ce système, piloté par une machine moléculaire appelée «inflammasome», est au centre de l’attention des scientifiques: une modération de cette fonction pourrait potentiellement contribuer à stopper une dangereuse inflammation permanente à son point de départ. Cette approche précise ayant pour but de réduire le niveau d’inflammation dans l’organisme s’inscrit dans le cadre d’un effort plus large visant à trouver de nouveaux moyens de traiter les maladies chroniques, à savoir la maladie d’Alzheimer et le cancer, en passant par l’arthrose et la goutte.
Face à cette idée étonnamment simple de cibler uniquement l’inflammasome, il semble plutôt étrange qu’elle n’ait pas déjà été lancée. Mais il y a seulement deux décennies, personne ne savait qu’un tel capteur de danger existait.
«D’un point de vue évolutionniste, c’est l’un des plus anciens mécanismes biologiques, et nous n’en avons pris connaissance que récemment», déclare Guido Junge, expert en maladies inflammatoires aux Novartis Institutes for BioMedical Research (NIBR). «Nous supposons qu’il joue un rôle majeur dans de nombreuses maladies.»
Un puissant système
En 2001, des scientifiques américains ont découvert une mutation dans un gène qui fonctionne dans la production d’une protéine appelée NLRP3. À l’époque, ils ne savaient qu’une chose sur la NLRP3: les mutations altérant cette protéine sont catastrophiques pour les personnes chez qui elles se produisent.
«C’était un rêve devenu réalité que de trouver enfin ce gène», déclare Dan Kastner, expert en maladies inflammatoires et directeur scientifique du National Human Genome Research Institute aux Etats-Unis. A la fin des années 90, il a découvert les origines génétiques de certaines maladies connexes. «Bien que l’on ait spéculé sur le fait que ce gène pourrait d’une certaine manière réguler l’inflammation, personne ne connaissait son mode d’action réel. L’idée d’un traitement était donc loin d’être envisageable à l’époque.»
Non traités, les enfants porteurs des mutations de la NLRP3 présentent une fièvre quasi constante, des frissons et des douleurs articulaires. L’inflammation chronique fait des ravages et leur vie est souvent très courte.
Peu de temps après la découverte de la NLRP3, les chercheurs ont établi un lien entre cette NLRP3 et l’inflammasome, et d’autres recherches l’ont reliée à un signal inflammatoire appelé «IL-1 bêta». Cette découverte portait l’espoir de nouvelles découvertes car: des niveaux élevés d’IL-1 bêta sont un signe d’inflammation chronique pouvant servir de guide.
«Vous regardez des tonnes de données et soudain vous voyez un modèle», explique G.Junge. «Un signal qui pourrait aider à orienter les thérapies.»

Aujourd’hui, les médicaments bloquant le signal inflammatoire IL-1 bêta permettent aux patients porteurs de mutations de la NLRP3 de vivre plus longtemps et plus sainement.
«L’inflammasome est un système très performant qui peut être modulé de manière très avantageuse», explique D. Kastner. Selon lui, «ces premiers succès de la recherche nous donnent l’espoir d’un bénéfice dans des situations plus subtiles et difficiles, par exemple dans le cas des maladies chroniques».
Maladies chroniques et capteur de danger hors de contrôle
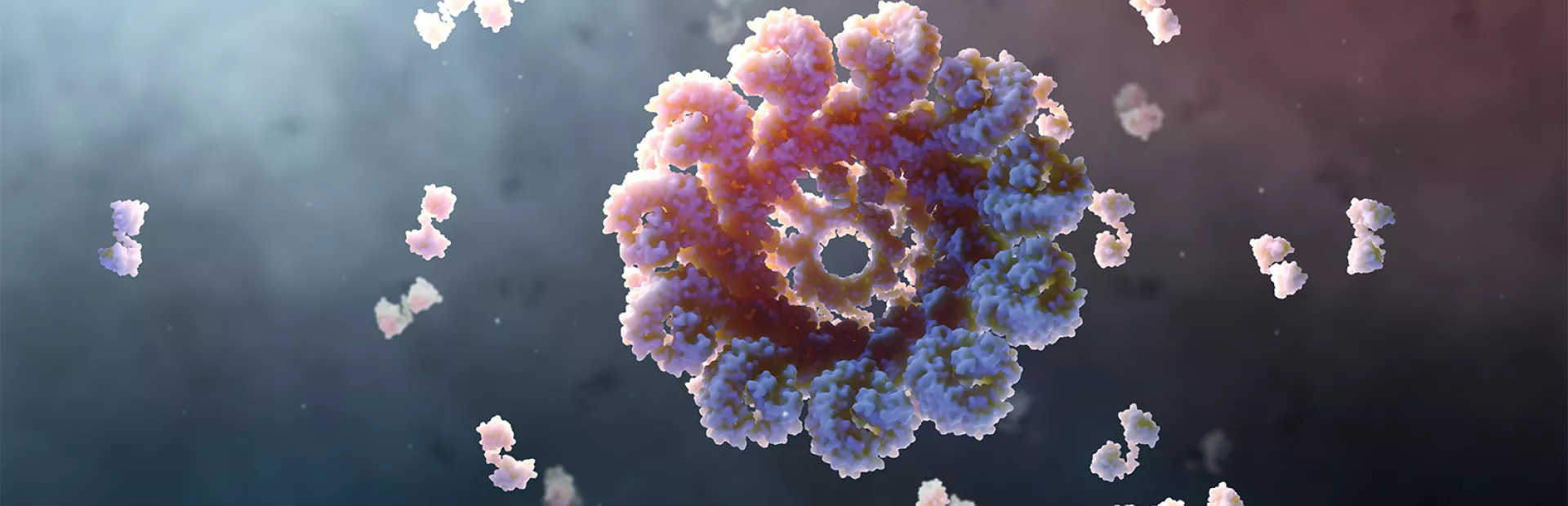
Les chercheurs ont finalement découvert que la NLRP3 est un capteur de danger, et le corps humain en dispose de 24. La plupart d’entre eux réagissent aux bactéries et aux virus. Mais le capteur NLRP3 est différent: il reconnaît les cristaux, les agrégats de protéines et le stress cellulaire malsain.
Dès qu’il perçoit ces dangers, il s’assemble en un inflammasome qui ressemble à un canon à rayons microscopiques. Son rôle consiste à alerter le reste du système immunitaire pour qu’il déclenche une réaction inflammatoire afin de résoudre le problème.
Souvenez-vous de l’arroseur défectueux: la situation devient critique lorsque le capteur NLRP3 envoie continuellement des signaux d’alarme. D’une part, cela peut être dû à des mutations dans le gène, mais les chercheurs ont également découvert que les maladies chroniques peuvent aussi faire en sorte que le capteur NLRP3 perçoive en permanence le danger.
Dans la maladie d’Alzheimer par exemple, les dépôts présents dans le cerveau peuvent déclencher le capteur. De même, l’artériosclérose chez les patients atteints de maladies cardiovasculaires et les cristaux apparaissant chez les patients goutteux peuvent générer un état inflammatoire constant par le biais d’un feu continu de signaux d’alarme.
Il s’agit probablement de l’un des plus anciens mécanismes biologiques. Nous supposons qu’il joue un rôle majeur dans de nombreuses maladies.
Guido Junge
«Si notre système immunitaire est alarmé de manière chronique, ce n’est pas bon du tout», précise Jörg Eder, expert en immunologie chez Novartis. «La plupart des gens pensent que le problème réside dans la maladie proprement dite, mais les lésions tissulaires peuvent aussi provenir directement du système immunitaire.»
Dans le cas du cancer par exemple, les cellules tumorales agissent insidieusement en tant que signaux de danger et déclenchent l’inflammasome. L’inflammation qui en découle favorise finalement la croissance tumorale au lieu de déclencher une attaque contre le tissu cancérogène. Par conséquent, les cellules cancéreuses persistent et continuent d’agir tels des signaux de danger.
«Les maladies chroniques peuvent provoquer un cercle vicieux d’inflammation, de détériorations et plus encore d’inflammation», explique G. Junge.
L’inflammasome NLRP3 peut être également impliqué dans certains cas de COVID-19. Chez certains patients atteints de COVID-19, il se produit une réponse immunitaire incontrôlée au coronavirus. Les médecins qualifient ce processus d’«orage cytokinique» car le système immunitaire inonde pratiquement les poumons de signaux inflammatoires tels que l’IL-1 bêta. C’est un exemple de la manière dont un déferlement de signaux immunitaires en réponse aux dommages viraux peut se muer en une violente tempête susceptible d’occasionner des lésions graves et permanentes. Des scientifiques du monde entier testent les médicaments actuels qui calment le système immunitaire afin de voir s’ils pourraient être sûrs et efficaces contre la maladie de COVID-19.
Juguler le capteur de danger
Plusieurs entreprises, dont Novartis, ont identifié un certain nombre d’options pour stopper l’inflammasome NLRP3. Il existe de nombreuses approches viables allant du blocage des signaux produits par l’inflammasome à la prévention de la mobilisation de l’inflammasome.
Les chercheurs de Novartis ont trouvé un moyen de bloquer l’activation de la NLRP3. Dans le même temps, des chercheurs d’une société dénommée «IFM Tre» ont fait une découverte similaire. Les deux approches se sont avérées complémentaires et ont atteint le même objectif anti-inflammatoire de différentes manières.
Novartis a fait l’acquisition d’IFM Tre en 2019 et devient ainsi la première entreprise à avoir testé une thérapie anti-NLRP3 lors d’essais cliniques antérieurs chez l’homme. Bien d’autres suivront car: il reste beaucoup à apprendre sur la manière dont les patients atteints de maladies chroniques répondent à cette approche thérapeutique.
«C’est la lourde tâche qui nous attend», déclare J. Eder. «Nous devons trouver les foyers d’inflammation chronique déclenchant la réaction en chaîne fatale de la NLRP3 et commencer à tester notre hypothèse sur les patients», conclut-il.