Il y a vingt ans, de nouveaux médicaments de précision ont changé la manière dont nous traitons le cancer en ciblant les protéines spécifiques présentant des dysfonctionnements qui déclenchent la maladie individuelle d'un patient. Mais le cancer est une maladie complexe. Les scientifiques qui ont travaillé à l'application la plus large possible de cette approche ont été confrontés à un défi, parmi tant d'autres: La plupart des protéines cancérigènes connues étaient considérées comme «incurables».
Que peut-on faire? L'une des possibilités consisterait à aider la cellule à se débarrasser de ses déchets.
Que signifie d'ailleurs «incurables»?
L'objectif des médicaments anticancéreux est d'empêcher les cellules malades de se développer de manière incontrôlée, tout en maintenant les cellules normales aussi saines que possible.
Comme les protéines défectueuses provoquent une croissance cellulaire incontrôlée, une stratégie importante consiste à empêcher ces protéines de se développer. Pour y parvenir, les scientifiques peuvent développer des médicaments inhibiteurs d'activité qui se lient à des sites très spécifiques d'une protéine cible - comme une clé qui ne s'insère que dans un trou de serrure spécifique.
Cependant, de nombreuses protéines - dont une famille de composants appelés facteurs de transcription, qui font partie des protéines les plus souvent mutées dans le cancer - ne possèdent pas a priori les propriétés nécessaires pour être traitées au moyen de médicaments ciblés comme le veut la chimie médicale classique. En fait, ces protéines sont «incurables» parce qu'il leur manque un trou de serrure.
Élimination précise des déchets
La plupart d'entre nous se souviennent certainement des cours de biologie à l'école et de l'analogie entre une cellule et une ville; avec des routes, des centrales électriques, des entrepôts et bien d'autres choses encore. Mais ce n'est pas tout: Les cellules disposent même d'un système d'élimination des déchets - spécialement pour les protéines.
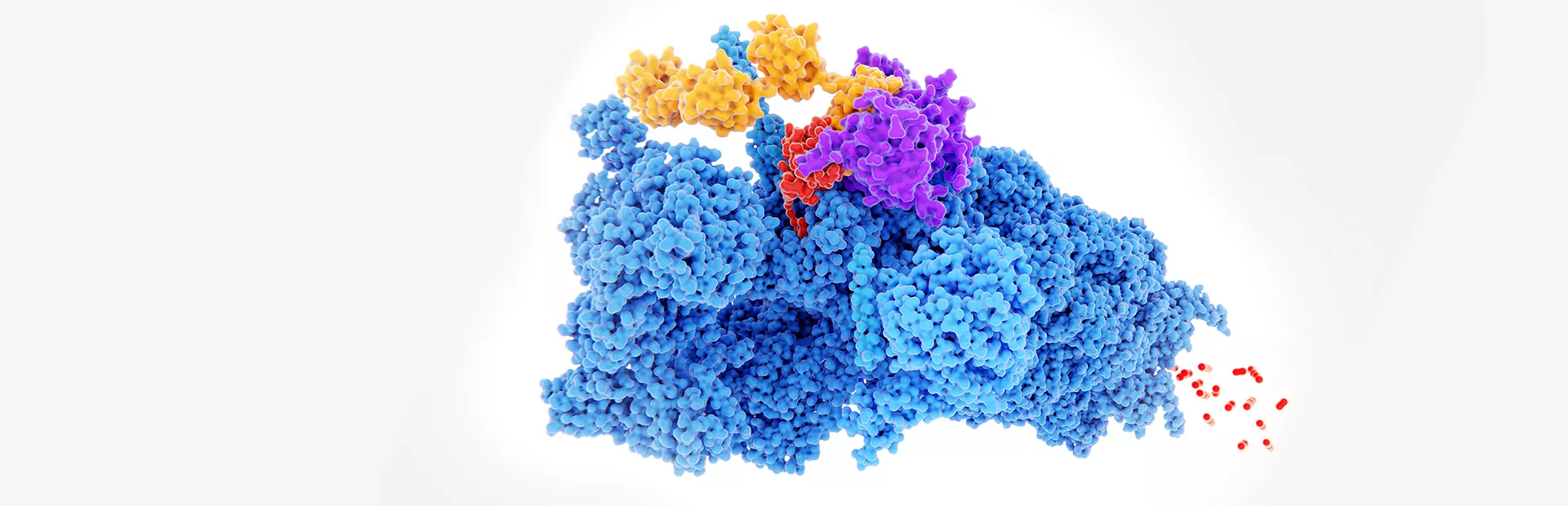
Il s'agit d'une machine cellulaire appelée protéasome, une sorte de camion poubelle qui parcourt la cellule et élimine les protéines obsolètes, indésirables ou cassées. Pour ce faire, le protéasome détermine quelles protéines doivent être dégradées à l'aide d'un marqueur chimique appelé ubiquitine, qui est fixé aux protéines par d'autres machines moléculaires spécialisées.
Si les scientifiques parviennent à trouver comment marquer correctement une protéine cible avec l'ubiquitine, cela pourrait ouvrir la porte à de nouvelles thérapies potentielles. Cette approche, appelée dégradation ciblée des protéines (en anglais targeted protein degradation, TPD), permettrait non seulement d'inhiber l'activité d'une protéine incontrôlée, mais aussi de l'éliminer complètement de la cellule - y compris les protéines «incurables» susmentionnées. Pour le dire de manière plus vulgaire: Plutôt que de chercher uniquement le bon trou de serrure pour une protéine cancérigène, on pourrait tenter de jeter le tout à la poubelle.
La dégradation ciblée des protéines n'en est encore qu'à ses débuts et les scientifiques de Novartis travaillent d'arrache-pied pour exploiter son potentiel au profit des patients. Des outils tels que des adhésifs moléculaires sont utilisés pour tenter d'amener la machinerie de marquage de l'ubiquitine de la cellule à interagir avec les protéines cibles, afin que le protéasome puisse les dégrader.
Ce processus ne se limite pas aux protéines des cellules cancéreuses - la dégradation ciblée des protéines pourrait contrôler des protéines potentiellement «incurables» dans d'autres cellules, par exemple dans certaines cellules T, afin d'améliorer les résultats de l'immunothérapie.