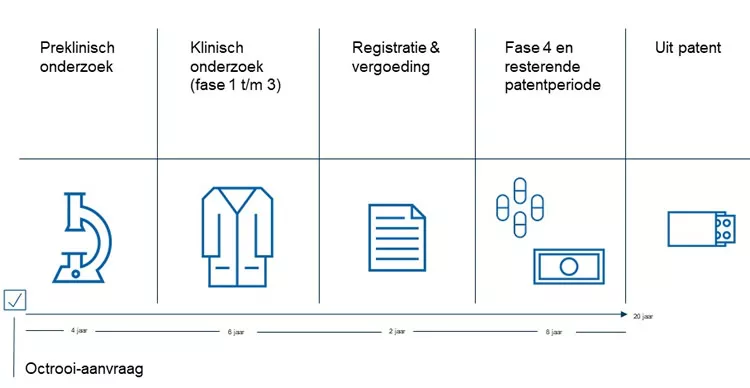
Op onderstaande tijdslijn zie je de verschillende fases van het gehele proces. Per fase is er een korte toelichting. Gemiddeld duurt de preklinische en klinische onderzoeksperiode (fase 1 t/m 3) zo’n 10 jaar en zijn kosten tussen de €1 en 1,5 miljard euro geen uitzondering.